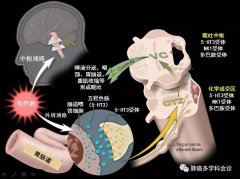
BEACON碧康制药
由欧洲财团参与投资,南亚地区唯一执行欧盟技术规范的上市制药企业,产品符合欧洲药典和美国药典标准。
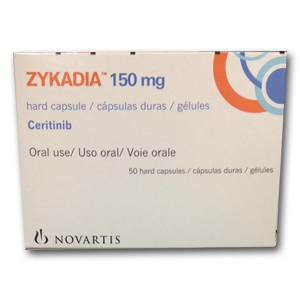
美国食品和药物管理局(FDA)已批准诺华公司对患者的治疗间变性淋巴瘤激酶阳性(ALK +),转移性非小细胞肺癌(NSCLC)或不能耐受的患者们使用色瑞替尼的治疗。该药物的批准满足医疗需求,患者使用这种药物可跟进既往的肺癌治疗进展。
肺癌是全世界癌症死亡的首要原因。肺癌的最常见的类型是非小细胞肺癌,占所有的情况下85-90%的。其中,2%-7%由ALK基因的重排造成的,从而促使癌细胞的增加生长,尽管患者ALK +非小细胞肺癌显著治疗进展,病情恶化往往是不可避免的,所以我们需要更多的选择。 色瑞替尼的批准是基于一个重要试验,其中包括163例转移性ALK +非小细胞肺癌进展或不能容忍与色瑞替尼治疗。因为转移研究中的患者人群中最常见的部位是大脑(60%),肝癌(42%)和骨(42%)。
在以前治疗的患者,色瑞替尼有效率为54.6%的,最常见的不良反应(至少25%的发病率)为腹泻,恶心,转氨酶升高,呕吐,腹痛,乏力,食欲减退及便秘。
诺华公司总裁肿瘤临时全球负责人亚历山德罗·里瓦说:“色瑞替尼不到三年半后的第一个病人进入了我们的临床试验批准,体现了是可能的一种高度集中的方法来药物开发和强有力的合作”。
色瑞替尼是ALK的口服,选择性抑制剂,在肺癌治疗中起着重要的治疗目标。 ALK是可以与其他基因融合形成的异常“融合蛋白”,促进开发和癌细胞生长的基因。色瑞替尼是继美国FDA突破性治疗称号,接受在关键试验和ALK +非小细胞肺癌的严重和危及生命的自然观察结果的意义被批准的第一个药物之一。