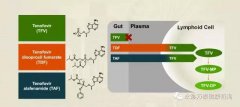
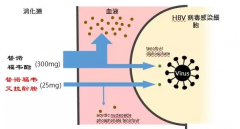
BEACON碧康制药
由欧洲财团参与投资,南亚地区唯一执行欧盟技术规范的上市制药企业,产品符合欧洲药典和美国药典标准。
4月7日,美国食品药物管理局(FDA)批准扩大Harvoni(雷迪帕韦/索非布韦)、Sovaldi(索非布韦)用于HCV感染的适应症补充申请,可用于治疗12~17岁的儿童和青少年慢性HCV感染患者。Harvoni和Sovaldi之前被批准用于成人丙肝患者,是美国批准的第一个用于青少年丙肝患者的直接抗病毒(DAA)药物。
FDA药物评估与研究中心抗微生物制剂办公室主任Edward Cox指出:“本次批准将有助于解决儿童和青少年患者治疗需求未满足这一问题,帮助改善HCV治疗的格局。
本次获批的适应症为:
◆ Sovaldi(索非布韦):联合利巴韦林,适用于基因型2、3型HCV慢性感染,无肝硬化或伴轻度肝硬化,体重≥35 kg,年龄在12岁及以上的儿童和青少年患者。
Sovaldi的疗效和安全性监管文件的提交基于一项开放标签的研究,该研究纳入了50例12岁及以上的儿童丙型肝炎患者,给予Sovaldi联合利巴韦林治疗,GT2型和GT3型患儿的SVR12分别达到了100%和97%,与成人患者的疗效相似。
Sovaldi联合利巴韦林的最常见不良事件为疲劳和头痛。所有利巴韦林禁忌症的情况均为Sovaldi联合利巴韦林治疗的禁忌症。
◆ Harvoni(雷迪帕韦/索非布韦):适用于基因型1、4、5、6型HCV慢性感染,无肝硬化或伴轻度肝硬化,体重≥35 kg,年龄在12岁及以上的儿童和青少年患者。
本次Harvoni的疗效和安全性监管文件的提交基于一项开放标签、多中心临床研究。该研究纳入了100例HCV GT1型的12岁及以上的儿童患者,研究结果显示,98%的患儿获得了SVR12,疗效与成年人相似。基因型4、5和6型HCV感染显示出相似的安全性和疗效。
Harvoni最常见的不良反应为疲劳和头痛。
据FDA称,Harvoni和Sovaldi都带有黑框警告,提示对于HCV/HBV合并感染的患者,可能有导致乙肝病毒再激活的风险。因此,所有HCV感染患者(包括儿童患者)都应筛选当前或既往感染HBV的证据。
本次Harvoni的疗效和安全性监管文件的提交基于一项开放标签、多中心临床研究。该研究纳入了100例HCV GT1型的12岁及以上的儿童患者,研究结果显示,98%的患儿获得了SVR12,疗效与成年人相似。基因型4、5和6型HCV感染显示出相似的安全性和疗效。
Harvoni最常见的不良反应为疲劳和头痛。
据FDA称,Harvoni和Sovaldi都带有黑框警告,提示对于HCV/HBV合并感染的患者,可能有导致乙肝病毒再激活的风险。因此,所有HCV感染患者(包括儿童患者)都应筛选当前或既往感染HBV的证据。