BEACON碧康制药
由欧洲财团参与投资,南亚地区唯一执行欧盟技术规范的上市制药企业,产品符合欧洲药典和美国药典标准。
导读
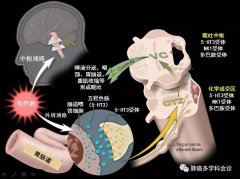
脑转移在非小细胞肺癌(NSCLC)患者中很常见,大约30%~50%的转移性非小细胞肺癌患者会发生脑转移。若无相应治疗,其中位生存时间仅为1-2个月。
目前NSCLC脑转移的治疗方法主要包括手术、放疗[包括全脑放疗(WBRT)、立体定向放疗(SRS)]、化疗等。
单纯手术切除脑转移病灶可有效缓解肿瘤压迫,但术后颅内局部复发率较高;WBRT或SRS可显著延长患者生存期,但患者往往难以忍受放疗相关的并发症或不良反应;而大多数化疗药物无法通过血脑屏障(blood brain barrier, BBB)进入肿瘤组织,因此限制了全身化疗对NSCLC脑转移患者的治疗效果。
由于预后不良和治疗方案选择有限,亟需开发新的有效药物和治疗策略。
基因突变对应的靶向治疗已经为肺癌患者带来了深远获益,包括预防或延迟脑转移的发生。靶向治疗和免疫治疗针对癌基因驱动的肺癌和脑转移患者显示出了不错的前景,并且与新型放疗技术相结合,正在推动NSCLC脑转移的治疗和预后的快速发展。
靶向治疗
中枢神经系统(CNS)是NSCLC常见的转移部位。Rangachari及其同事对381例患者(86例EGFR突变和23例ALK重排)进行了队列研究,发现脑转移的发生率较高,24.4%的EGFR突变和23.8%的ALK重排肺癌患者中首次诊断时即存在CNS转移。脑转移瘤3年累计发病率为EGFR突变患者为46.7%,ALK重排肺癌患者为58.4%。
使用EGFR-TKIs和ALK-TKIs已经在转移性NSCLC中产生了较高的全身应答率(RR),并且在一线治疗中改善了无进展生存期(PFS)。与放射疗法联合用于治疗脑转移的系统方案有可能减少CNS治疗的相关毒性,同时延长寿命。
一
EGFR突变的肺癌
大约10%~20%的肺腺癌患者存在EGFR突变。第一代和第二代EGFR-TKI(包括厄洛替尼,吉非替尼和阿法替尼)在CNS中有活性,多项回顾性研究显示EGFR突变患者的脑RR超过50%,并且与EGFR野生型患者相比存活时间延长。
在EGFR-TKI获得性耐药中,T790M突变约占63%,也就是说一代EGFR-TKI治疗后有2/3的患者疾病进展都与T790M突变相关,但在脑转移瘤中比在全身转移瘤中少见,这可能是由于中枢神经系统中药物渗透度较低,因此药物暴露程度较低。
标准150 mg每日剂量的厄洛替尼脑脊液(CSF)浓度低于全身血药浓度,因为该药物的BBB渗透率为2.8%至5.1%。阿法替尼是第二代EGFR-TKI,为不可逆抑制剂,脑渗透浓度<1%。
Osimertinib
尽管阿法替尼已被FDA批准可一线治疗EGFR突变患者,但在治疗获得性耐药方面的疗效不尽如人意。osimertinib是万众瞩目的肺癌第三代EGFR突变抑制剂,用于治疗EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌。
临床前证据显示Osimertinib在小鼠脑组织中浓度的比血浆中高5至25倍,并且在小鼠模型中显示出比吉非替尼,厄洛替尼或阿法替尼更大的BBB渗透率。在小鼠移植EGFR敏感突变肺癌脑转移模型中显示出强大的肿瘤抑制作用,不仅可克服一代TKI耐药的问题,在耐药后出现脑膜转移治疗方面也有一定优势。
Osimertinib BLOOM I期试验更新结果显示,无论患者的T790M状态如何,osimertinib均可导致MRI信号强度变化,提示中枢神经系统(CNS)病灶缩小。
BLOOM研究的进一步数据显示,osimertinib可穿越血脑屏障。9例患者中有6例观察到CSF中EGFR突变水平降幅超过50%,此降低持续至治疗的第9个周期的第1天,其中5例观察到持续降低。上述结果支持既往报道的osimertinib穿越血脑屏障的临床前数据。
III期AURA3研究显示,osimertinib的中位CNS PFS显著长于化疗(11.7 vs 5.6个月;风险比[HR]0.32; P = .004)。osimertinib中枢神经系统总缓解率(ORR)为70%(30例患者中有21例),而化疗组为31%。
最近发表的FLAURA研究显示,osimertinib用于未经治疗的晚期EGFR突变阳性的NSCLC患者,osimertinib较厄洛替尼或吉非替尼带来显著无进展生存获益,同时证实了osimertinib具有很好的CNS活性,相比一代EGFR-TKI有更好的穿透血脑屏障的能力,能够有效控制CNS患者的疾病进展。
正在开发的其他化合物,包括ASP8273,PF-7775,EGF816和HM61713在脑转移患者中的正式数据仍然需要等待。
02
第一代EGFR抑制剂脉冲式给药
所谓脉冲式给药,也称为策略性用药,即短时间内大剂量用药。主要是通过增加给药浓度来提高脑脊液中的血药浓度最终控制脑转移肿瘤。
埃罗替尼(erlotinib)是表皮生长因子受体(EGFR)酪氨酸激酶抑制剂,主要用于局部晚期或转移性非小细胞肺癌二线或三线治疗。在小规模的回顾性系列研究中,高剂量埃罗替尼以“脉冲式”给药方式(每周1,500 mg)试图在EGFR突变型肺癌的软脑膜转移患者中获得更高的CSF药物浓度和部分缓解。
在一项研究中,这种方法导致9名患者中有6名患者出现中枢神经系统部分缓解;然而在另一项研究中,10名患者中只有1名以相同策略出现部分缓解,并报告了1.7个月的中位总生存期(OS)。另一项研究发现在脑膜瘤患者中出现了与后者相似的结果,高剂量EGFR TKI导致10例患者中有3例(30%)出现客观缓解。
在34名肺癌脑转移患者的一线治疗中,所有患者均接受脉冲式厄洛替尼治疗。在阶段I剂量递增研究中,发现第1天和第2天的最大耐受剂量为1,200mg,每周3至7天;由于中枢神经系统转移,没有患者退出研究,27名可评估患者中有22名(81%)具有全身性部分缓解。
迄今为止,还没有系统地比较脉冲式给药和标准给药之间差异的随机化试验,脉冲疗法是一种尝试,希望将来有更多的数据支持。
03
EGFR突变患者的其他治疗策略
大量研究表明,阻断EGFR表达的靶向抑制剂能够增加肿瘤细胞的放射敏感性,提高放射治疗的疗效,其机制可能与抑制细胞增殖、诱导细胞凋亡、干扰细胞周期分布、延长DNA的损伤修复有关。
多年来WBRT一直是多发NSCLC脑转移的主要局部治疗措施之一。在未选择的II期研究中,WBRT联合标准剂量厄洛替尼患者耐受良好,ORR为86%。
SRS已经成为治疗脑转移瘤的一线选择,它既可用于WBRT后效果的提高,也可作为独立的治疗方案。当使用SRS作为一个单一的治疗方案,局部和远端的大脑复发率从73.0%到76.4%不等;当与WBRT联合使用时,复发率从27.0%到46.8%。作为系统性疗法改善,SRS治疗后,新发或复发脑转移瘤的患者有可能增加。关于补救治疗的安全性和有效性的证据是有限的,治疗方案的选择仍有争议。
目前正在努力开发能特异性穿透血脑屏障的EGFR抑制剂。对新型EGFR突变靶向药物AZD3759的研究表明,它具有较高的BBB被动渗透性,并且不受外排转运蛋白的影响。动物脑转移模型已经证实了该靶向药物显著的抗肿瘤作用。在AZD3759 I期临床试验中,脑转移患者中有63%(19名患者中有12名)达到了颅内缓解,50%(20名患者中有10名患者)达到了颅外缓解。尚不清楚AZD3759的BBB通透性与osimertinib的BBB通透性比较结果如何。
二
ALK重排的NSCLC
ALK融合基因发生于3%-7%的NSCLC患者。临床上常见于不吸烟的年轻腺癌患者,通常与EGFR或KRAS突变的发生互相排斥。一代ALK抑制剂克唑替尼,应用于ALK重排、ROS1重排、MET扩增和MET外显子14跳跃突变的NSCLC患者。
然而,几项前瞻性研究显示,克唑替尼一线PFS是10.2月-11.1月,约40%患者发生耐药时以CNS进展为主,表明克唑替尼对颅内病灶控制欠佳,并促使了第二、三代ALK抑制剂的发展与超越:Alectinib及Ceritinib已得到FDA批准的,而二代Brigatinib及三代lorlatinib正处于临床研究阶段。
Ceritinib
Ceritinib是二代ALK-TKI,在体内试验中可通过血脑屏障,且在克唑替尼耐药患者中仍具有临床疗效。
Ceritinib的I期ASCEND-1试验对124例脑转移患者进行评估,在不考虑脑转移灶以及是否接受过其他ALK抑制剂的情况下,色瑞替尼在治疗ALK重排的NSCLC中表现出一定的有效性。在II期ASCEND-2试验中,6例脑受累患者中有5例中枢神经系统DCR为80.0%。据报道,恶心,腹泻和呕吐是最常见的不良事件。另一项II期研究(ASCEND-3)在13名基线可测量脑受累的患者中,颅内缓解率为61.5%。
Ceritinib治疗ALK重排的颅内转移性疾病和软脑膜疾病的第二阶段研究(ASCEND-7)正在进行中,在这项研究中,脑脊液样本将进行评估,以进一步调查此药的颅内渗透情况。
02
Alectinib
与crizotinib相比,alectinib的药代动力学的临床前研究显示拥有极好的CNS渗透性。据报道,中枢神经系统中alectinib的浓度为血清中测得的浓度的63%至94%。其对ALK的抑制作用高于克唑替尼约5倍,且可抑制大多数克唑替尼耐药的ALK突变。
来自两项单臂II期研究(NCT01871805和NCT01801111)汇总的有效性和安全性数据显示,在163例基线CNS转移患者中,CNS ORR为64.0%,CNS DCR为90.0%,中位随访时间12.4个月,平均中位疗程为10.8个月。对于接受过放射治疗的患者,ORR为35.8%,未接受放疗的患者为58.5%。
ALUR试验的结果以及ALEX试验的次要分析和早期AF-002JG研究结果显示,在一线和二线治疗NSCLC中加入alectinib的减少CNS进展。ALUR试验招募了107例既往接受铂类化疗和克唑替尼治疗后患有ALK阳性NSCLC和进行性疾病的患者。在基线可测量CNS转移患者中,alectinib治疗组的CNS ORR为54.2%,而化疗组为0%(P <0.001)。中枢神经系统进行性疾病的6个月累积发病率alectinib为11%,化疗组为48%。与化疗组相比,alectinib组的PFS显著延长(分别为9.6个月和1.4个月; HR,0.15; P <0.001)。观察到中枢神经系统DCR的显著差异(alectinib组为80.6%,化疗组为28.6%),神经认知测试有所改善。
alectinib与crizotinib的一线ALEX研究中,亚组分析显示alectinib组中有12%的患者发生CNS进展,而crizotinib组有45%(HR,0.16; P <.001)。在接受alectinib治疗的21例患者中有17例发生中枢神经系统反应(81%),alectinib组的颅内反应中位持续时间为17.3个月,crizotinib组为5.5个月。这些结果与之前报道的J-ALEX研究结果一致。
J-ALEX也是一个大型的三期临床试验,在日本进行。 J-ALEX研究结果提示:Alectinib组和克唑替尼组的ORR分别为91.6%和78.9%;中位PFS分别为未达到(95%CI:20.3-未达到)和10.2月。
03
Brigatinib
在初始I/II期试验中,53%(8/15)患者可测量的≥10mm脑转移灶获得颅内病灶的客观缓解;颅内疾病控制率为87%。在颅内缓解的患者(n=19)中,中位缓解持续时间为18.9个月。brigatinib治疗克唑替尼耐药的患者有一定的抗肿瘤活性;未接受克唑替尼治疗的ALK阳性NSCLC患者ORR为100%,包括患者基线有脑转移(可测量病灶的患者中颅内ORR为53%)。
在II期ALTA试验中,brigatinib继续在基线脑转移的ALK重排阳性NSCLC患者中显示出强大的颅内有效性。脑转移灶可测量的患者经brigatinib 180毫克给药方案治疗后,三分之二获得颅内缓解,中位颅内缓解持续时间达16.6个月。
04
Lorlatinib
Lorlatinib是多靶点的ALK和ROS1抑制剂,为第三代ALK抑制剂正处于临床研究阶段,相比现有的ALK抑制剂,其潜在的优势在于血脑屏障通透性更高,且对TKI耐药的ALK突变的治疗效果更好。
正在进行的I/II期研究(ClinicalTrials.gov的标识符:NCT01970865)的I期剂量递增研究中,在ALK阳性或ROS1阳性的晚期NSCLC且大多数伴有CNS转移和之前经历过两种或以上TKI治疗失败的患者中,劳拉替尼既显示出全身性的作用,也显示出颅内的作用。
FDA已经授予Lorlatinib突破性疗法的认定,用于治疗先前接受过一种或多种ALK抑制剂的ALK阳性转移性非小细胞肺癌患者。
放疗联合靶向治疗
美国国家综合癌症网络(NCCN)临床实践指南建议,对于无症状脑转移NSCLC患者应单独使用ALK抑制剂治疗。克唑替尼联合放疗副作用的相关数据甚少。因此因颅内病变应用克唑替尼的患者放疗前必须停药至少1天,一般联合治疗可增加疾病控制率且毒性可接受。
有症状的患者应考虑手术治疗±SRS或WBRT,其次是ALK抑制剂。具有较小转移灶的患者建议SRS治疗以避免WBRT导致的认知能力下降。考虑到CNS转移的频率,ALK阳性患者也可能从间隔时间较短的MRI监测中受益。
免疫治疗
免疫检查点抑制剂目前被批准用于很多可能转移至脑部的恶性肿瘤,包括黑素瘤,肾细胞癌和NSCLC(鳞状和腺癌)。免疫治疗药物对于非小细胞肺癌患者的疗效已在临床上初步显现,但对于肺癌脑转移的患者使用免疫治疗的有效率有多大一直处于模糊状态。
有研究表明,脑转移瘤中肿瘤浸润淋巴细胞的密度与肿瘤患者的OS呈现相关性。在nivolumab治疗鳞状NSCLC(CheckMate 063)的II期临床试验中,有4例脑转移患者入选,其中2例可评价,两者在CNS病变中均有反应。 CheckMate 012是nivolumab在晚期NSCLC中正在进行的一项试验,其中包含评估未经治疗的无症状脑转移患者的安全性和耐受性。
在黑色素瘤患者中进行了一些关于检查点抑制剂对CNS转移影响的初步研究,包括ipilimumab的II期临床试验的回顾性分析,该试验在12例基线CNS转移患者中有5例显示颅内反应。额外的II期数据显示这类患者的1年生存率为20%。Pembrolizumab在转移性NSCLC中的初步临床数据显示,9例可评估患者中4例获得了部分缓解(44%)。
放疗联合免疫治疗
放疗可以导致癌细胞坏死,集中释放大量抗原,吸引免疫细胞趋化到肿瘤部位杀伤癌细胞;而免疫治疗通过促进抗原呈递、减少肿瘤微环境中的免疫抑制因素而增强肿瘤特异性免疫效应,两者结合使用可以进一步增强肿瘤特异性免疫效应,目前已有大量相关临床研究报道。
放疗的“远隔效应”即不仅仅是放疗照射野内的肿瘤会出现缓解,远离照射野的肿瘤也会出现缓解。放疗联合免疫治疗可以提高“远隔效应”发生率。
目前放疗联合免疫治疗主要从两个方向着手,一是促进肿瘤抗原识别和呈递,主要是利用GM-CSF、FLT3配体、TOLL样受体激动剂促进树突状细胞成熟、增殖;二是消除肿瘤微环境中的免疫抑制因素,主要是利用免疫拮抗点抑制剂,如CTLA-4抑制剂、PD-1/PD-L1抑制剂。此外还有利用免TGFβ抑制剂。相关临床研究正在开展。
结论
新药和新技术的结合正在改变我们治疗肺癌脑转移的方式。正在进行的每一步研究和探索都有可能对脑转移患者的临床治疗产生积极的影响。
参考文献:
Systemic Treatment Options for Brain Metastases from Non–Small-Cell Lung Cancer.cancernetwork.com.2018.