BEACON碧康制药
由欧洲财团参与投资,南亚地区唯一执行欧盟技术规范的上市制药企业,产品符合欧洲药典和美国药典标准。
导读
4月30日美国食品和药物管理局(FDA)扩大了达拉菲尼(Tafinlar)与曲美替尼(Mekinist)在黑色素瘤的适应征。5月4日又传捷报,FDA批准达拉菲尼与曲美替尼联合用于治疗无法手术切除的晚期或转移性、BRAF V600E突变阳性的甲状腺未分化癌(ATC)。
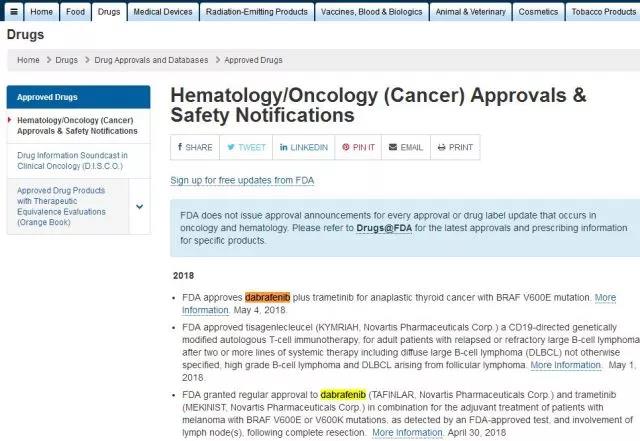
美国国立卫生研究院(NIH)估计,2018年美国将有53,990例甲状腺癌新发病例和2,060例死亡病例。其中,ATC约占所有甲状腺癌的1%~2%。ATC是一种罕见的侵袭性甲状腺癌,预后较差。
这是FDA批准的第一种针对这种侵袭性甲状腺癌患者的治疗方案。该批准是基于BRF117019(NCT02034110)研究,这是一项9对列的非随机试验,共23例可评估的BRAF V600E突变ATC患者。总有效率为61%(95% CI: 39%, 80%),部分缓解率57%,完全缓解率4%。64%的患者反应持续时间在6个月以上。
ATC队列研究中所有患者的不良反应与之前批准的其他适应证一致。常见的副作用包括发热,皮疹,寒战,头痛,关节痛,咳嗽,疲劳,恶心,呕吐,腹泻,肌肉疼痛,皮肤干燥,食欲下降,水肿,出血,高血压和呼吸困难。
本次推荐的剂量与治疗黑色瘤的一致:达拉菲尼 150 mg 口服 每日两次,曲美替尼2 mg 口服 每日一次。
达拉菲尼和曲美替尼分别针对RAS/RAF/MEK/ERK通路中的BRAF和MEK,它们通常存在于非小细胞肺癌和黑色素瘤等癌症中。当两者一起使用时,其在延缓肿瘤生长方面的效果优于单药治疗。
2014年1月10日,FDA批准达拉菲尼和曲美替尼联合治疗BRAF V600E或V600K突变的不可手术或转移性黑色素瘤。
2017年6月,FDA批准了达拉菲尼和曲美替尼联合治疗晚期BRAF突变的非小细胞肺癌患者:有效率64%,疾病控制率为100%。
2018年4月30日,FDA批准达拉菲尼和曲美替尼联合用于III期BRAF V600E-或V600K阳性黑色素瘤患者术后辅助治疗,使肿瘤复发率降低53%。
来自转移性黑素瘤和肺癌以及其他BRAF V600E突变阳性罕见癌症试验的数据给ATC患者带来了信心,本次获批通过了优先审查,FDA还授予达拉菲尼和曲美替尼联合治疗为BRAF V600突变未分化甲状腺癌的“突破性疗法”和“孤儿药”。
期待这一强大的组合能早日应用于国内患者。
参考来源:
https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm606708.htm